La risposta ce la fornisce il microscopio
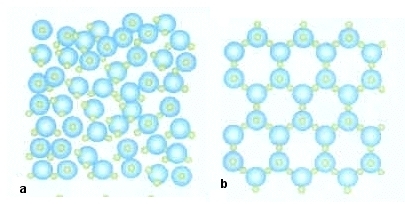
Durante il processo di solidificazione, le molecole dell’acqua si dispongono in maniera abbastanza larga. Questo avviene perché riducendo la temperatura, le molecole iniziano a muoversi sempre meno instaurando dei legami a ponte di idrogeno che uniscono le molecole in strutture cristalline di forma esagonale con delle cavità. Il ghiaccio quindi galleggia perché ha una densità minore rispetto all’acqua allo stato liquido.
Quando il ghiaccio fonde, il suo volume si riduce perché le molecole d’acqua, in seguito alla rottura dei loro legami reciproci, possono occupare gli interstizi che si producono durante lo scioglimento. Se osservati al microscopio, anche nella forma liquida si formano questi legami, ma la loro formazione e distruzione è continua, perciò non si formano né i cristalli, né le cavità, conferendo al liquido una densità maggiore rispetto al solido.